1. Introducción al Fósforo (P)
1.1. Definición y Posición en la Tabla Periódica
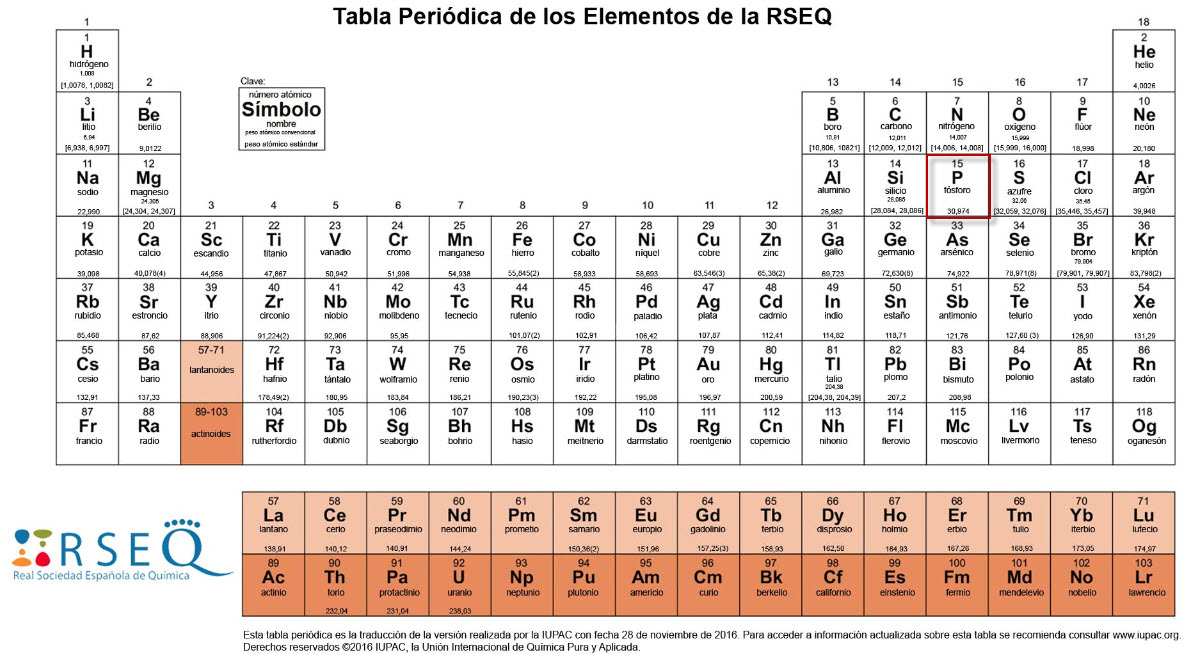
El fósforo es un elemento químico fundamental, clasificado como no metal, cuyo símbolo químico es P y su número atómico es 15.1 Se ubica en el grupo 15 de la tabla periódica, conocido como el grupo de los nitrogenoideos, y en el período 3.2 Esta posición indica que posee 5 electrones en su capa de valencia (3s23p3) 8, lo que gobierna gran parte de su comportamiento químico, incluyendo su multivalencia y capacidad para formar una amplia gama de compuestos.
1.2. Descubrimiento y Etimología
El descubrimiento del fósforo se atribuye al alquimista alemán Hennig Brandt en Hamburgo, alrededor de 1669.3 Brandt aisló el elemento mientras buscaba la mítica piedra filosofal, calentando al rojo vivo residuos de orina evaporada mezclada con arena.3 Observó que los vapores desprendidos brillaban en la oscuridad, condensándose en una sustancia cerosa blanca que emitía la misma luz.14 Brandt mantuvo su hallazgo en secreto, pero fue redescubierto independientemente por otro alquimista alemán, Kunckel, en 1677.3
El nombre «fósforo» proviene del latín phosphŏrus y este del griego φωσφόρος (phosphoros), que significa «portador de luz».3 Este nombre hace referencia directa a la característica emisión de luz verdosa (quimioluminiscencia) que exhibe una de sus formas, el fósforo blanco, al reaccionar lentamente con el oxígeno del aire en la oscuridad.9 Es importante destacar que este fenómeno es una quimioluminiscencia, resultado de una reacción química, y no una fosforescencia verdadera, que implica la reemisión de luz absorbida previamente.11
El descubrimiento del fósforo por Brandt es un hito en la historia de la química. Representa el primer descubrimiento de un elemento químico desde la antigüedad cuya identidad del descubridor es conocida.9 Este evento, nacido de la práctica alquímica pero basado en la experimentación y el aislamiento de una sustancia pura, simboliza un paso importante en la transición hacia la química moderna. La búsqueda de la transmutación de la materia, objetivo central de la alquimia, condujo inesperadamente al aislamiento de un nuevo elemento fundamental.
1.3. Abundancia y Presencia Natural
Dada su alta reactividad química, el fósforo nunca se encuentra en estado elemental libre en la naturaleza.2 Existe siempre combinado con otros elementos, principalmente en forma de fosfatos inorgánicos.2 Constituye aproximadamente el 0.11% de la corteza terrestre, siendo el undécimo elemento más abundante.15
La principal fuente mineral de fósforo son las rocas fosfáticas, entre las que destacan la apatita, cuya fórmula general es Ca5(PO4)3(F,Cl,OH) o, de forma idealizada, 3Ca3(PO4)2⋅CaX2 (donde X puede ser F, Cl o OH) 9, y la fosforita, una forma menos cristalina de composición similar a la fluoroapatita.15 Existen importantes yacimientos de estas rocas en países como Marruecos, China, Rusia y Estados Unidos.9
Además de su presencia mineral, el fósforo es un elemento químico esencial para todos los organismos vivos conocidos.2 Desempeña roles cruciales en la estructura y función celular, como se detallará más adelante.
2. Propiedades Físicas y Alótropos del Fósforo
2.1. Propiedades Físicas Generales
En condiciones normales de presión y temperatura, el fósforo elemental es un sólido.6 Su masa atómica es de aproximadamente 30.9738 unidades de masa atómica (u).2 Las propiedades físicas como densidad, punto de fusión, punto de ebullición y conductividad varían significativamente dependiendo de la forma alotrópica considerada. Para la forma más común en condiciones estándar, el fósforo blanco (forma α), la densidad es de aproximadamente 1.82−1.83g/cm3 2, el punto de fusión es de $44.1-44.2 \, ^\circ C$ (317.3K) 2, y el punto de ebullición es de $277-280 \, ^\circ C$ (550−553K).2 Como no metal, el fósforo en sus formas blanca y roja es un mal conductor del calor y la electricidad.10 Sin embargo, el fósforo negro exhibe conductividad eléctrica, comportándose como un semiconductor.9
2.2. Alotropía del Fósforo
Una característica distintiva del fósforo es su capacidad para existir en diversas formas alotrópicas, que son diferentes estructuras del mismo elemento en el mismo estado físico. Estas formas poseen propiedades físicas y químicas marcadamente distintas.4 Las más importantes y comunes son el fósforo blanco, el fósforo rojo y el fósforo negro.
2.2.1. Fósforo Blanco (P4)
- Estructura: Es una sustancia molecular constituida por moléculas tetraédricas discretas P4.11 En este tetraedro, cada átomo de fósforo está unido a otros tres mediante enlaces covalentes simples. Los ángulos de enlace P−P−P son de solo 60∘ 15, un valor muy inferior al ángulo natural para un átomo trivalente, lo que genera una considerable tensión angular y de enlace en la molécula.15 Esta tensión es la causa principal de su alta reactividad e inestabilidad termodinámica relativa. El fósforo blanco existe en dos formas cristalinas: la forma α, estable a temperatura ambiente, con estructura cúbica; y la forma β, con estructura hexagonal, estable por debajo de $-78.0 \, ^\circ C$ (195.2 K).11
- Apariencia: Es un sólido blando, translúcido, con una consistencia similar a la cera.9 Recién preparado y puro es incoloro 10, pero rápidamente adquiere una tonalidad amarillenta al exponerse a la luz, debido a una lenta transformación superficial en fósforo rojo.16 Posee un olor característico y penetrante, a menudo descrito como similar al ajo.9
- Propiedades: Debido a su naturaleza molecular con débiles fuerzas intermoleculares, tiene puntos de fusión ($44 \, ^\circ C$) y ebullición ($280 \, ^\circ C$) relativamente bajos.2 Es bastante volátil, presentando una presión de vapor significativa a temperatura ambiente.2 Es insoluble en agua 2, pero soluble en disolventes no polares o poco polares como el disulfuro de carbono (CS2), benceno y aceites.11 Es el alótropo menos denso.11
2.2.2. Fósforo Rojo
- Obtención: Se produce al calentar fósforo blanco en ausencia de aire a temperaturas entre $250 \, ^\circ C$ y $300 \, ^\circ C$, o por exposición prolongada del fósforo blanco a la luz solar o radiación UV.2 Esta transformación es una reacción exotérmica 2, lo que indica que el fósforo rojo es energéticamente más estable que el blanco.
- Estructura: A diferencia del blanco, el fósforo rojo no está formado por moléculas P4 discretas. Posee una estructura polimérica compleja, que puede ser amorfa o cristalina (tras un calentamiento prolongado).11 Se considera que se forma por la ruptura de uno de los enlaces P−P en cada tetraedro P4 y la posterior formación de enlaces entre estas unidades, creando redes tridimensionales.11 Cada átomo de fósforo mantiene un entorno piramidal, pero los ángulos de enlace promedio ($ \approx 101^\circ$) están mucho menos tensionados que en el P4.15
- Apariencia: Se presenta comúnmente como un polvo de color rojo-violáceo.11
- Propiedades: Es más denso que el fósforo blanco.15 Su punto de fusión es considerablemente más alto (alrededor de $600 \, ^\circ C$), lo que refleja la necesidad de romper enlaces covalentes de la red polimérica para fundirlo.15 Es mucho menos volátil que el blanco.2 Es insoluble en agua y en la mayoría de los disolventes orgánicos, incluyendo el CS2.15
2.2.3. Fósforo Negro
- Obtención: Es la forma alotrópica termodinámicamente más estable del fósforo, pero también la más difícil de obtener.11 Se prepara calentando fósforo blanco bajo presiones muy elevadas (aproximadamente 12,000atm o 1.2GPa) a unos $200-220 \, ^\circ C$ 13, o calentando fósforo rojo bajo presión.33 También se ha reportado su obtención en condiciones ambientales utilizando catalizadores metálicos.11
- Estructura: Posee una estructura polimérica lamelar (en capas), similar a la del grafito.9 La forma más común es ortorrómbica, con átomos de fósforo dispuestos en capas plegadas de anillos de seis miembros interconectados, donde cada átomo de P está unido a otros tres.32
- Apariencia: Es un sólido de color negro o gris oscuro, con aspecto escamoso o laminar y brillo metálico.9
- Propiedades: Es el alótropo más denso (d≈2.69g/cm3).11 A diferencia de las otras formas, es un conductor de la electricidad, comportándose como un semiconductor.9 No es inflamable 9 y es la forma menos reactiva del fósforo.11
2.2.4. Otras Formas Alotrópicas
Existen otras formas menos comunes, como el fósforo violeta (o de Hittorf), obtenido por recocido del fósforo rojo a alta temperatura ($> 530 \, ^\circ C$) o recristalización en plomo fundido.11 Es polimérico, con estructura monoclínica o romboédrica, menos reactivo que el rojo e insoluble.13 También se menciona el fósforo escarlata 11 y el difósforo (P2), una molécula diatómica estable solo a muy altas temperaturas ($> 800-1200 \, ^\circ C$) en fase gaseosa.11 Recientemente, se han investigado nanoestructuras como los nanotubos de fósforo y el fosforeno (análogo bidimensional del grafeno derivado del fósforo negro).32
2.3. Relación Estructura-Propiedad en Alótropos
La marcada diferencia en las propiedades de los alótropos del fósforo es una consecuencia directa de sus distintas estructuras atómicas y moleculares. La molécula tetraédrica P4 del fósforo blanco, con sus ángulos de enlace forzados a 60∘, almacena una cantidad significativa de energía de tensión.15 Esta tensión hace que los enlaces P−P sean relativamente débiles y la molécula sea cinéticamente muy reactiva y termodinámicamente metaestable.11 Esto se traduce en su baja temperatura de ignición (piroforicidad), alta volatilidad y elevada toxicidad.2
Por el contrario, las formas roja y negra poseen estructuras poliméricas extendidas, donde los átomos de fósforo forman redes tridimensionales o laminares.11 En estas estructuras, los ángulos de enlace están más relajados y cercanos a los valores preferidos para el fósforo 15, resultando en una mayor estabilidad termodinámica y una menor reactividad química.2 La estructura polimérica también explica su mayor densidad, mayor punto de fusión (especialmente el rojo) y su insolubilidad generalizada.15 El fósforo negro, con su estructura laminar similar al grafito, permite la deslocalización de electrones, lo que le confiere propiedades semiconductoras.9
2.4. Diversidad de Aplicaciones basada en la Alotropía
Esta amplia gama de propiedades resultante de la alotropía es precisamente lo que permite al fósforo elemental encontrar aplicaciones tan diversas y, a veces, contrapuestas. La extrema reactividad e inflamabilidad del fósforo blanco se explota en usos militares como agente incendiario y para generar cortinas de humo.4 Por otro lado, la mayor estabilidad y menor toxicidad del fósforo rojo lo hacen adecuado para su uso en las superficies de fricción de las cajas de cerillas de seguridad.4 La estabilidad y las propiedades semiconductoras del fósforo negro, y especialmente de su derivado bidimensional, el fosforeno, abren perspectivas para aplicaciones en electrónica y optoelectrónica.9 Así, la capacidad del fósforo para adoptar diferentes arreglos estructurales se traduce directamente en una versatilidad funcional única.
2.5. Tabla Comparativa de Alótropos Principales
La siguiente tabla resume y compara las propiedades clave de los tres alótropos más importantes del fósforo:
| Propiedad | Fósforo Blanco (P4) | Fósforo Rojo | Fósforo Negro |
| Estructura | Molecular (Tetraedros P4) 32 | Polimérica (Redes 3D) 32 | Polimérica (Capas tipo grafito) 32 |
| Apariencia | Sólido ceroso, blando, blanco/amarillento 32 | Polvo rojo-violáceo 32 | Sólido negro/gris, escamoso, brillo metálico 13 |
| Densidad (g/cm3) | ~1.83 2 | ~2.16 15 | ~2.69 15 |
| Punto de Fusión (∘C) | 44 2 | ~600 33 | Sublima |
| Punto de Ebullición (∘C) | 280 2 | Sublima | Sublima |
| Solubilidad (Agua) | Insoluble 2 | Insoluble 33 | Insoluble |
| Solubilidad (CS2) | Soluble 33 | Insoluble 16 | Insoluble |
| Conductividad Eléctrica | Aislante 11 | Aislante | Semiconductor 32 |
| Reactividad | Muy alta (Pirofórico) 32 | Moderada (Estable al aire) 32 | Muy baja (Inerte) 32 |
| Estabilidad Termodinámica | Menos estable 32 | Intermedia 33 | Más estable 32 |
| Toxicidad | Muy alta (Letal) 32 | Baja 11 | No tóxico |
Esta tabla proporciona una visión general comparativa que resalta las diferencias fundamentales entre los alótropos, facilitando la comprensión de sus comportamientos y usos dispares.
3. Propiedades Químicas del Fósforo
3.1. Reactividad General y Estados de Oxidación
El fósforo es un no metal químicamente activo 38, aunque su reactividad varía drásticamente según la forma alotrópica, siguiendo el orden: Blanco >> Rojo > Negro.9 La alta reactividad del fósforo blanco se debe, como se mencionó, a la tensión inherente en la molécula P4.15 Esta forma es pirofórica, oxidándose espontáneamente e incluso inflamándose en contacto con el aire a temperatura ambiente o ligeramente superior.9 El fósforo rojo es significativamente más estable; requiere ser calentado a temperaturas de $300-400 \, ^\circ C$ para reaccionar apreciablemente con el oxígeno.11 El fósforo negro es el más inerte de los alótropos.11
El fósforo exhibe múltiples estados de oxidación en sus compuestos, siendo los más comunes -3 (en fosfuros y fosfina), +3 (en P4O6, H3PO3, PX3) y +5 (en P4O10, H3PO4, PX5, fosfatos).4 También se han identificado otros estados de oxidación como -2, -1, +1, +2 y +4 en compuestos menos comunes.8 Los óxidos de fósforo tienen carácter ácido.9
3.2. Reacción con Oxígeno
La reacción con oxígeno es una de las propiedades químicas más características del fósforo, especialmente del alótropo blanco.
- Combustión: El fósforo blanco arde vigorosamente en presencia de aire u oxígeno, a menudo de forma espontánea si la temperatura supera los $30-50 \, ^\circ C$ o si está finamente dividido.2 La reacción es fuertemente exotérmica y produce una llama de color amarillo-verdoso.15 Reacciona violentamente con agentes oxidantes fuertes.4
- Formación de Óxidos: Dependiendo de la cantidad de oxígeno disponible, se forman dos óxidos principales:
- Con oxígeno limitado: Se forma el óxido de fósforo(III), P4O6 (hexaóxido de tetrafósforo). Ecuación: P4(s)+3O2(g)→P4O6(s).15
- Con exceso de oxígeno: Se forma el óxido de fósforo(V), P4O10 (decaóxido de tetrafósforo, comúnmente llamado pentóxido de fósforo). Ecuación: P4(s)+5O2(g)→P4O10(s).4 Este óxido se presenta como un humo blanco denso.4 Ambos óxidos conservan una estructura derivada del tetraedro P4, con átomos de oxígeno insertados en los enlaces P−P (P4O6) y adicionalmente en los vértices (P4O10).11
- Quimioluminiscencia: Como se mencionó, el fósforo blanco expuesto al aire en la oscuridad emite un característico brillo verdoso pálido.9 Este fenómeno, históricamente llamado «fosforescencia», es en realidad una quimioluminiscencia resultante de la oxidación lenta del vapor de fósforo en presencia de humedad. Durante esta oxidación se forman intermedios electrónicamente excitados (posiblemente PO∗ y (PO)2∗) que emiten luz al retornar a su estado fundamental.11
3.3. Reacción con Halógenos
El fósforo reacciona directamente con los halógenos (Flúor, Cloro, Bromo, Yodo) para formar haluros de fósforo. Se conocen dos series principales de haluros: los trihaluros (PX3) y los pentahaluros (PX5).15
- Trihaluros (PX3): Se forman generalmente por reacción directa del fósforo con una cantidad controlada de halógeno. Por ejemplo: P4(s)+6Cl2(g)→4PCl3(l).44 El PF3 es una excepción, ya que la reacción directa con F2 produce PF5 debido al alto poder oxidante del flúor; el PF3 se obtiene por reacciones de intercambio de halógeno (ej. PCl3+AsF3→PF3+AsCl3).43
- Pentahaluros (PX5): Se forman cuando el fósforo reacciona con un exceso de halógeno. Por ejemplo: P4(s)+10Cl2(g)→4PCl5(s).43 También pueden obtenerse por reacción del trihaluro correspondiente con más halógeno: PCl3(l)+Cl2(g)→PCl5(s).43 El PI5 no es estable y no se conoce.44
3.4. Reacción con Agua
La interacción del fósforo y sus compuestos con agua varía considerablemente.
- Fósforo Elemental: El fósforo blanco es prácticamente insoluble en agua.2 Esta propiedad, combinada con su reactividad con el aire, hace que el almacenamiento bajo agua sea el método estándar para manejarlo de forma segura, ya que el agua actúa como una barrera física contra el oxígeno.9
- Óxidos: Los óxidos de fósforo son anhídridos de ácido y reaccionan con agua:
- P4O6 reacciona con agua fría para formar ácido fosforoso (H3PO3): P4O6(s)+6H2O(l)→4H3PO3(aq).15 Con agua caliente, la reacción puede ser más compleja, pudiendo liberar fosfina (PH3).46
- P4O10 reacciona muy vigorosamente con agua, con desprendimiento de calor (siseo), para formar ácido ortofosfórico (H3PO4): P4O10(s)+6H2O(l)→4H3PO4(aq).15 Esta gran afinidad por el agua hace que el P4O10 sea un agente deshidratante extremadamente eficaz.15
- Haluros: Tanto los trihaluros como los pentahaluros de fósforo sufren hidrólisis en contacto con agua, produciendo el oxoácido de fósforo correspondiente y el haluro de hidrógeno (HX).43
- PX3+3H2O→H3PO3+3HX (ej. PCl3 da H3PO3 y HCl).43 La hidrólisis del PF3 es notablemente lenta debido a la fortaleza del enlace P−F.43
- PX5+4H2O→H3PO4+5HX (ej. PCl5 da H3PO4 y HCl).43 La hidrólisis de los pentahaluros suele ser más rápida y completa que la de los trihaluros. Para PCl5, la reacción ocurre en etapas, formando primero oxicloruro de fósforo (POCl3).43
3.5. Reacción con Bases (Desproporción)
El fósforo blanco experimenta una reacción de desproporción (o dismutación) cuando se calienta con soluciones acuosas concentradas de bases fuertes, como hidróxido de sodio (NaOH) o hidróxido de potasio (KOH).40 En esta reacción redox, el fósforo elemental (estado de oxidación 0) es simultáneamente reducido a fosfina (PH3, estado de oxidación -3) y oxidado a ion hipofosfito (H2PO2−, estado de oxidación +1). La ecuación iónica neta general es:
P4(s)+3OH−(aq)+3H2O(l)ΔPH3(g)+3H2PO2−(aq) 45
Esta reacción no solo ilustra la compleja química redox del fósforo, sino que también constituye un método clásico de laboratorio para la preparación de fosfina y sales de hipofosfito.45
3.6. Toxicidad
La toxicidad del fósforo elemental y algunos de sus compuestos es un aspecto crítico.
- Fósforo Blanco: Es extremadamente venenoso por ingestión, inhalación o contacto con la piel.9 Una dosis tan baja como 50−100mg puede ser letal para un adulto.9 Causa quemaduras químicas muy graves, profundas y dolorosas que penetran los tejidos y tardan en cicatrizar, pudiendo incluso llegar al hueso.9 Las partículas de fósforo blanco incrustadas en la herida pueden volver a inflamarse al exponerse al aire.37 La absorción sistémica puede causar daño hepático severo, fallo renal, alteraciones cardíacas y daño al sistema nervioso central.32 La exposición crónica, históricamente común en trabajadores de la industria de cerillas, provocaba una enfermedad debilitante conocida como necrosis fosfórica de la mandíbula («phossy jaw»).9
- Fósforo Rojo: Es considerablemente menos tóxico que el blanco.2 Sin embargo, debe manejarse con precaución, ya que puede contener trazas de fósforo blanco como impureza o puede revertir parcialmente a la forma blanca si se calienta intensamente, liberando vapores tóxicos.10
- Otros Compuestos: El vapor del óxido P4O6 es muy venenoso.38 La fosfina (PH3) es un gas extremadamente tóxico e inflamable, que afecta principalmente al sistema respiratorio y nervioso central.13 Muchos compuestos organofosforados sintéticos son altamente tóxicos y actúan como potentes neurotoxinas (pesticidas, agentes nerviosos).11
3.7. Manejo y Almacenamiento
La alta reactividad y toxicidad del fósforo blanco dictan precauciones de manejo muy estrictas. Su tendencia a inflamarse espontáneamente en el aire (piroforicidad) 9 requiere que se almacene siempre sumergido en agua (en la que es insoluble) para evitar el contacto con el oxígeno atmosférico.9 Debe manipularse con pinzas, preferiblemente bajo agua, y evitar todo contacto con la piel.12 El fósforo rojo, al ser mucho más estable y menos reactivo, no requiere estas precauciones extremas y puede almacenarse en contacto con el aire.10
4. Métodos de Obtención del Fósforo Elemental
4.1. Proceso Industrial Principal: Horno de Arco Eléctrico
El método predominante para la producción industrial de fósforo elemental es el proceso térmico en horno de arco eléctrico.54
- Materias Primas: Las materias primas esenciales son:
- Roca fosfática: Minerales ricos en fosfato de calcio, como apatita o fosforita (Ca3(PO4)2).9 La roca puede requerir un pretratamiento, como la nodulización o sinterización, para aglomerar las partículas finas, facilitar el escape del vapor de fósforo y evitar que el polvo contamine el producto.56
- Coque: Una forma de carbono (C) que actúa como agente reductor.9
- Sílice: Arena (SiO2) que actúa como fundente ácido.9
- Proceso: La mezcla de estas materias primas se introduce en un horno de arco eléctrico, donde se calienta a temperaturas muy elevadas, típicamente entre $1400 \, ^\circ C$ y $1500 \, ^\circ C$, en ausencia de aire (atmósfera reductora).9 El calor necesario es generado por la resistencia eléctrica al paso de corriente a través de grandes electrodos de carbono sumergidos en la carga.
- Reacciones Químicas: En el interior del horno ocurren varias reacciones complejas, que se pueden simplificar en los siguientes pasos clave:
- Reducción del Fosfato: El fosfato de calcio es reducido por el carbono (en forma de monóxido de carbono, CO, generado in situ por la reacción del coque con trazas de oxígeno o con CO2) a fósforo elemental. Una representación simplificada de la reducción directa por carbono es: 2Ca3(PO4)2(s)+10C(s)→P4(g)+10CO(g)+6CaO(s).15 El fósforo se libera en forma de vapor (P4) a estas temperaturas.
- Formación de Escoria: La sílice (SiO2), un óxido ácido, reacciona con el óxido de calcio (CaO), un subproducto básico de la reducción, para formar silicato de calcio (CaSiO3). Esta reacción es crucial porque el CaSiO3 es líquido a la temperatura del horno (forma una escoria fundida) y elimina el CaO del sistema: CaO(s)+SiO2(s)→CaSiO3(l).15 La eliminación del CaO desplaza el equilibrio de la reacción de reducción hacia la formación de fósforo, aumentando la eficiencia del proceso. Además, la escoria líquida se puede separar fácilmente.
- Reacción Global: Combinando las reacciones anteriores, la reacción neta global del proceso es: $2 Ca_3(PO_4)_2(s) + 6 SiO_2(s) + 10 C(s) \xrightarrow{1400-1500 \, ^\circ C} P_4(g) + 10 CO(g) + 6 CaSiO_3(l)$.15 Esta reacción es endotérmica en general, requiriendo el aporte continuo de energía eléctrica.
- Recuperación del Producto: Los gases calientes que salen del horno contienen vapor de fósforo (P4) y monóxido de carbono (CO), además de otras impurezas. Estos gases se enfrían y se hacen pasar a través de torres de condensación o precipitadores electrostáticos donde el vapor de fósforo se condensa. La condensación se realiza típicamente bajo una capa de agua caliente o ácido fosfórico diluido para prevenir la reoxidación y obtener directamente fósforo blanco líquido, que solidifica al enfriarse.15 La escoria líquida de silicato de calcio y el ferrofósforo (una aleación de hierro y fósforo formada a partir de impurezas de hierro en la roca) se extraen periódicamente del fondo del horno. El CO gaseoso puede ser utilizado como combustible en otras partes del proceso.
4.2. Métodos Históricos
Antes del desarrollo del proceso del horno eléctrico, se utilizaron otros métodos:
- Método de Brandt (1669): Como se mencionó, implicaba la destilación de residuos de orina (que contiene fosfatos como el fosfato de sodio y amonio) calentados con arena.3 La orina fue la única fuente de fósforo durante casi un siglo.12
- Método de Scheele (1771): Carl Wilhelm Scheele desarrolló un método para extraer fósforo a partir de cenizas de hueso (huesos calcinados), que son ricas en fosfato de calcio, tratándolas con ácido nítrico o sulfúrico y luego calentando el fosfato resultante con carbón.12
4.3. Consideraciones del Proceso Industrial
El proceso del horno eléctrico, aunque eficaz para producir fósforo elemental de alta pureza, es muy intensivo en el consumo de energía eléctrica.57 Debido a este alto coste energético, la producción de ácido fosfórico para fertilizantes (el mayor uso del fósforo) se realiza predominantemente por el «proceso húmedo», que consiste en atacar la roca fosfórica directamente con ácido sulfúrico.21 El proceso húmedo es más económico para la producción a gran escala de ácido fosfórico de grado fertilizante, aunque este resulta menos puro.55 El proceso térmico (horno eléctrico) se reserva principalmente para la producción de fósforo elemental como tal, o para la fabricación de ácido fosfórico de alta pureza (grado alimenticio o técnico), que se obtiene quemando el fósforo elemental a P4O10 y luego hidratándolo.55
5. Compuestos Importantes del Fósforo
El fósforo forma una vasta y diversa gama de compuestos químicos, tanto inorgánicos como orgánicos, que son fundamentales en la industria, la biología y la tecnología.
5.1. Óxidos de Fósforo
Los dos óxidos más importantes son P4O6 y P4O10.
- Óxido de Fósforo(III) (P4O6): También conocido como hexaóxido de tetrafósforo. Es un sólido cristalino blanco, con un olor descrito como similar al ajo, cuyo vapor es muy venenoso.38 Se forma por la combustión controlada de fósforo con una cantidad limitada de oxígeno.15 Es relativamente inestable y se oxida fácilmente al aire, especialmente al calentarlo ($ \approx 70 , ^\circ C$), para formar P4O10.38 Reacciona lentamente con agua fría para dar ácido fosforoso (H3PO3).15 Su estructura molecular se basa en el tetraedro P4 con un átomo de oxígeno insertado en cada uno de los seis enlaces P−P.15
- Óxido de Fósforo(V) (P4O10): Conocido comúnmente como pentóxido de fósforo (basado en la fórmula empírica P2O5) o decaóxido de tetrafósforo. Es un sólido blanco, muy higroscópico.15 Se obtiene por la combustión completa del fósforo en un exceso de aire u oxígeno.4 Su estructura deriva de la del P4O6, con un átomo de oxígeno adicional unido terminalmente a cada uno de los cuatro átomos de fósforo.11 Es un compuesto termodinámicamente muy estable, con una alta entalpía de formación negativa (−2984kJ/mol).38 Su característica más notable es su extraordinaria afinidad por el agua, con la que reacciona de forma muy vigorosa y exotérmica para formar ácido ortofosfórico (H3PO4).15 Esta propiedad lo convierte en uno de los agentes deshidratantes más potentes conocidos, capaz de eliminar agua de otros ácidos (ej. deshidratar HNO3 a N2O5) y secar gases y disolventes.15
5.2. Oxoácidos del Fósforo
El fósforo forma varios oxoácidos importantes, que difieren en el estado de oxidación del fósforo y en el número de átomos de hidrógeno ácidos.
- Ácido Fosfórico (H3PO4): Formalmente ácido ortofosfórico. Es, con diferencia, el oxoácido de fósforo más importante industrial y biológicamente.15 El fósforo se encuentra en su estado de oxidación más alto (+5). Se produce industrialmente a gran escala mediante el proceso húmedo (reacción de roca fosfórica con ácido sulfúrico) 21 o por hidratación del P4O10 obtenido en el proceso térmico.15 Es un ácido triprótico, lo que significa que puede donar hasta tres protones (H+) en solución acuosa, formando secuencialmente los iones dihidrógeno fosfato (H2PO4−), hidrógeno fosfato (HPO42−) y fosfato (PO43−).39 La mayor parte del ácido fosfórico producido se destina a la fabricación de fertilizantes fosfatados.15 También se utiliza en la industria química, como aditivo alimentario (acidulante en bebidas de cola, E338) 4, tratamiento de metales, catalizador y en odontología.
- Ácido Fosforoso (H3PO3): También conocido como ácido fosfónico. En este ácido, el fósforo tiene estado de oxidación +3.15 Se obtiene por hidrólisis del P4O6 15 o, más comúnmente, por hidrólisis del tricloruro de fósforo (PCl3).43 Aunque su fórmula es H3PO3, estructuralmente es HPO(OH)2, con un átomo de hidrógeno unido directamente al fósforo. Este enlace P−H no es ácido. Por lo tanto, el ácido fosforoso es un ácido diprótico, capaz de donar solo dos protones.47 Se presenta como un sólido blanco higroscópico (absorbe humedad del aire).47 Es un agente reductor moderadamente fuerte.47 Se utiliza como intermedio en la síntesis de otros compuestos de fósforo (como fosfitos y fosfonatos) y como agente reductor.47 Existe un equilibrio tautomérico entre la forma predominante HPO(OH)2 y la forma minoritaria P(OH)3.47
- Ácido Hipofosforoso (H3PO2): También llamado ácido fosfínico. Aquí, el fósforo está en su estado de oxidación más bajo (+1).15 Se prepara usualmente acidificando sus sales, los hipofosfitos, que se obtienen de la reacción de desproporción del fósforo blanco en medio básico.49 Su estructura es H2PO(OH), con dos átomos de hidrógeno unidos directamente al fósforo y solo uno unido al oxígeno.50 En consecuencia, es un ácido monoprótico, donando solo un protón.50 Es un poderoso agente reductor.50 Se utiliza principalmente para preparar sales de hipofosfito (usadas en recubrimientos metálicos sin electricidad – «electroless plating») y como agente reductor en síntesis orgánica.50
5.3. Fosfatos
Los fosfatos son las sales y ésteres derivados del ácido fosfórico. Son omnipresentes en la naturaleza y la industria.
- Ortofosfatos: Son los derivados del ion fosfato simple, PO43−.4 Esta es la forma en que el fósforo es asimilado por los organismos vivos.4 Son componentes esenciales del ADN, ARN, ATP y de la hidroxiapatita (Ca10(OH)2(PO4)6) que forma la matriz mineral de huesos y dientes.4 Industrialmente, los ortofosfatos (como el fosfato monoamónico – MAP, NH4H2PO4, y el fosfato diamónico – DAP, (NH4)2HPO4) son los fertilizantes fosfatados más importantes.15 También se usan como aditivos alimentarios 4 y en el tratamiento de aguas.25 Históricamente, fueron componentes clave de los detergentes, pero su uso se ha restringido drásticamente debido a su papel en la eutrofización de las aguas.4
- Fosfatos Condensados: Se forman por la unión de dos o más unidades de ortofosfato mediante la eliminación de moléculas de agua, creando enlaces P−O−P.21 Incluyen:
- Pirofosfatos: Contienen el ion P2O74−.
- Metafosfatos: Estructuras cíclicas con fórmula general (PO3)nn−.
- Polifosfatos: Cadenas lineales de unidades PO4 unidas. El tripolifosfato de sodio (Na5P3O10) fue un componente principal de los detergentes. Estos fosfatos condensados se utilizan en el tratamiento de aguas para secuestrar iones metálicos y prevenir la corrosión 25, como aditivos alimentarios 28 y en detergentes. En solución acuosa, tienden a hidrolizarse lentamente para formar ortofosfatos.59
- Fosfatos Orgánicos: Son ésteres del ácido fosfórico (con enlaces P−O−C) o compuestos donde el fósforo está unido a una molécula orgánica.25 Esta categoría abarca desde moléculas biológicas vitales como los ácidos nucleicos (ADN, ARN), el ATP y los fosfolípidos de las membranas celulares 4, hasta una amplia gama de compuestos sintéticos conocidos como organofosforados. Estos últimos incluyen muchos pesticidas (ej. malatión, paratión), herbicidas (ej. glifosato), plastificantes, retardantes de llama y los extremadamente tóxicos agentes nerviosos (ej. sarín, VX).4
La centralidad del ácido fosfórico y sus derivados, los fosfatos, es evidente. El H3PO4 actúa como el nexo principal entre la química industrial del fósforo y su papel biológico. La mayor parte del fósforo extraído se convierte en H3PO4 para fabricar fertilizantes 15, que devuelven el fósforo al ciclo biológico. Dentro de los organismos, el fósforo existe y funciona casi exclusivamente en forma de fosfato (derivado del H3PO4), formando la estructura de moléculas genéticas, membranas, huesos y siendo el actor clave en la transferencia de energía (ATP).4
Los compuestos organofosforados ilustran una fascinante dualidad. Mientras que los fosfatos orgánicos naturales como los fosfolípidos y los nucleótidos son indispensables para la estructura y función celular 11, muchos organofosforados sintéticos se cuentan entre las sustancias más tóxicas creadas, diseñadas específicamente por su letalidad como pesticidas o armas químicas.4 Esta diferencia radical en el efecto biológico, de esencial a mortal, surge de variaciones sutiles en la estructura molecular alrededor del átomo de fósforo, lo que altera drásticamente su interacción con sistemas biológicos, a menudo por inhibición de enzimas vitales como la acetilcolinesterasa.
5.4. Haluros de Fósforo
Como se mencionó, el fósforo reacciona con los halógenos para formar trihaluros (PX3) y pentahaluros (PX5).
- Trihaluros (PX3): Incluyen PF3 (gas incoloro), PCl3 (líquido incoloro fumante), PBr3 (líquido incoloro) y PI3 (sólido rojo inestable).18 Poseen una estructura molecular de pirámide trigonal, con el fósforo en el vértice y un par de electrones solitario.43 El PCl3 es un importante reactivo industrial, utilizado en la fabricación de otros compuestos de fósforo, incluyendo pesticidas, plastificantes y retardantes de llama.18 Los trihaluros se hidrolizan en agua para dar ácido fosforoso (H3PO3) y el haluro de hidrógeno correspondiente.43 También pueden actuar como ligandos en complejos de metales de transición.43
- Pentahaluros (PX5): Los más relevantes son PF5 (gas incoloro) y PCl5 (sólido cristalino de color blanco amarillento que sublima fácilmente).15 El PBr5 es un sólido amarillo-rojizo. En fase gaseosa, tienen una estructura de bipirámide trigonal.43 Sin embargo, en estado sólido, su estructura suele ser iónica para acomodar el tamaño de los halógenos: PCl5 existe como [PCl4]+[PCl6]− (iones tetraédrico y octaédrico), mientras que PBr5 es +Br−.38 Los pentahaluros son agentes halogenantes potentes y se hidrolizan completamente en agua para dar ácido fosfórico (H3PO4) y HX.43 El PCl5 se utiliza como agente clorante en síntesis orgánica.43
5.5. Fosfina (PH3)
La fosfina, o fosfuro de hidrógeno, es el hidruro más simple del fósforo. Es un gas incoloro, altamente inflamable y extremadamente tóxico, con un olor desagradable a menudo descrito como a ajo o pescado en descomposición (aunque la fosfina pura es inodora; el olor se debe a impurezas como la difosfina, P2H4).13 El fósforo se encuentra en estado de oxidación -3. Se produce por hidrólisis de fosfuros metálicos (ej. Ca3P2+6H2O→3Ca(OH)2+2PH3) 45 o por la desproporción de fósforo blanco en medio alcalino caliente.40 Es poco soluble en agua.49 Se utiliza principalmente como fumigante para granos almacenados y en la industria de semiconductores como fuente de fósforo para dopaje.45
5.6. Fosfuros
Son compuestos binarios formados por fósforo y un elemento menos electronegativo, generalmente un metal. Ejemplos incluyen el fosfuro de calcio (Ca3P2), fosfuro de aluminio (AlP) y fosfuro de magnesio (Mg3P2).51 Reaccionan con agua o ácidos diluidos para liberar fosfina gaseosa, lo que hace que algunos fosfuros metálicos se utilicen como rodenticidas o fuentes de fosfina para fumigación.45
6. Aplicaciones del Fósforo y sus Compuestos
El fósforo y sus derivados tienen una amplia gama de aplicaciones que abarcan desde la agricultura hasta la alta tecnología.
6.1. Agricultura: Fertilizantes
El uso más significativo del fósforo a nivel mundial es en la fabricación de fertilizantes.4 El fósforo es uno de los tres macronutrientes primarios (N, P, K) indispensables para el crecimiento y desarrollo de las plantas.24 Los fertilizantes fosfatados promueven el desarrollo robusto de las raíces, mejoran la floración y la formación de frutos y semillas, aumentan la resistencia de las plantas a enfermedades y estrés ambiental, y contribuyen a una maduración más temprana y uniforme de los cultivos.81
- Tipos de Fertilizantes Fosfatados:
- Superfosfato Simple (SSP): Obtenido tratando roca fosfórica con ácido sulfúrico. Contiene fosfato monocálcico (Ca(H2PO4)2) soluble y sulfato de calcio (yeso).26
- Superfosfato Triple (TSP): Obtenido tratando roca fosfórica con ácido fosfórico. Es más concentrado en fósforo que el SSP, ya que no contiene yeso.26
- Fosfatos Amónicos (MAP y DAP): Fosfato monoamónico (NH4H2PO4) y fosfato diamónico ((NH4)2HPO4). Se producen neutralizando ácido fosfórico con amoniaco.21 Son los fertilizantes fosfatados más utilizados actualmente, ya que aportan tanto fósforo como nitrógeno.
- Roca Fosfórica Molida: Aplicación directa de roca fosfórica finamente molida al suelo. El fósforo se libera lentamente, dependiendo de la acidez del suelo.26
- Fertilizantes Orgánicos: Fuentes como harina de hueso, harina de pescado y compost proporcionan fósforo de liberación lenta y mejoran la estructura del suelo.81
- Fertilizantes Tecnológicos: Formulaciones avanzadas que buscan mejorar la eficiencia del uso del fósforo, como fertilizantes de liberación controlada, recubiertos, o biofertilizantes que utilizan microorganismos para mejorar la disponibilidad del fósforo.66
- Estruvita Recuperada: El fosfato de amonio y magnesio hexahidratado (MgNH4PO4⋅6H2O), recuperado de aguas residuales, se está utilizando como un fertilizante de liberación lenta eficaz y sostenible.31
El uso de fertilizantes fosfatados ha sido crucial para aumentar la producción mundial de alimentos y garantizar la seguridad alimentaria.24 Sin embargo, su aplicación ineficiente o excesiva conduce a la escorrentía de fósforo hacia los cuerpos de agua, siendo la principal causa de eutrofización en ecosistemas de agua dulce.19 Esto representa un dilema fundamental: la necesidad de fósforo para alimentar a una población creciente frente al impacto ambiental negativo de su uso. La solución radica en mejorar la eficiencia de la fertilización (aplicar la cantidad correcta en el momento adecuado), desarrollar fertilizantes más eficientes y minimizar las pérdidas al medio ambiente.
6.2. Industria
- Detergentes: Los polifosfatos, especialmente el tripolifosfato de sodio, fueron ampliamente utilizados como «builders» en detergentes para ropa y lavavajillas. Actuaban secuestrando iones Ca2+ y Mg2+ (ablandando el agua), manteniendo la suciedad en suspensión y tamponando el pH. Sin embargo, su contribución a la eutrofización llevó a su prohibición o restricción severa en muchos países.4
- Cerillas: Las cerillas de seguridad modernas utilizan fósforo rojo mezclado con un material abrasivo (como vidrio en polvo) en la superficie de fricción de la caja. La cabeza de la cerilla contiene un agente oxidante (como clorato de potasio) y azufre o sulfuro de antimonio. La fricción genera calor, que inicia la reacción entre el fósforo rojo y el oxidante, encendiendo la cerilla.4 Las antiguas cerillas «strike-anywhere» contenían sesquisulfuro de fósforo (P4S3) en la cabeza.15
- Metalurgia: Se utiliza en la producción de aceros especiales y aleaciones no ferrosas. El bronce fosforoso (aleación de cobre, estaño y fósforo) es conocido por su dureza, resistencia y bajo coeficiente de fricción. El ferrofósforo se añade al acero para mejorar su maquinabilidad.38 También actúa como desoxidante en la fundición de metales.
- Industria Alimentaria: El ácido fosfórico se usa como acidulante, especialmente en bebidas de cola (E338).4 Diversas sales de fosfato (de sodio, potasio, calcio) se emplean como agentes leudantes en panadería, reguladores de acidez, emulsionantes, estabilizantes, secuestrantes y como suplementos minerales.28
- Tratamiento de Aguas: Los fosfatos (orto y poli) se añaden al agua potable en pequeñas cantidades para controlar la corrosión de las tuberías formando una capa protectora.25 Por otro lado, la eliminación del fósforo es una etapa crucial en el tratamiento de aguas residuales para prevenir la eutrofización.25
- Pesticidas y Herbicidas: Muchos insecticidas, herbicidas y fungicidas importantes son compuestos organofosforados.4 Su mecanismo de acción a menudo implica la inhibición de enzimas clave en las plagas.
- Otros Usos Industriales: Producción de plásticos y resinas 18, retardantes de llama (compuestos fosforados) 45, aditivos para lubricantes 18, agentes de limpieza industrial 4, catalizadores químicos, producción de fosfina 45, y en la fabricación de lámparas y tubos fluorescentes (aunque el término «fosforescencia» aquí se refiere a la luminiscencia de otros materiales, no al fósforo elemental).
6.3. Tecnología
- Semiconductores: El fósforo es un dopante de tipo n comúnmente utilizado en la fabricación de semiconductores de silicio para crear regiones con exceso de electrones. La fosfina (PH3) se utiliza como gas precursor en procesos de deposición química de vapor (CVD) para introducir fósforo en el silicio.45 Además, las propiedades semiconductoras inherentes del fósforo negro y del fosforeno están siendo investigadas activamente para futuras aplicaciones en electrónica, optoelectrónica y dispositivos de almacenamiento de energía.9
- Baterías: El fosfato de hierro y litio (LiFePO4) es un material de cátodo importante y cada vez más utilizado en baterías recargables de ion-litio, especialmente para vehículos eléctricos y almacenamiento de energía estacionario, debido a su buena estabilidad térmica, larga vida útil, bajo costo y mayor seguridad en comparación con otros materiales de cátodo.53
- Recuperación de Fósforo (Economía Circular): Ante la creciente preocupación por la eutrofización y la seguridad del suministro de fósforo (la roca fosfórica es un recurso finito y no renovable 53), se están desarrollando e implementando tecnologías para recuperar el fósforo de diversas corrientes residuales, principalmente aguas residuales municipales e industriales, y lodos de depuradora. La tecnología más madura es la precipitación de estruvita (MgNH4PO4⋅6H2O).31 Este proceso elimina simultáneamente fósforo y nitrógeno (amonio) del agua residual mediante la adición de una fuente de magnesio (como MgCl2 u MgO) y el ajuste del pH (generalmente a 8-9).63 La estruvita precipitada se recupera como un producto granular que es un excelente fertilizante de liberación lenta, rico en P, N y Mg.31 Este enfoque de recuperación y reutilización es un ejemplo claro de economía circular, transformando un contaminante (exceso de nutrientes en aguas residuales) en un recurso valioso (fertilizante), reduciendo la contaminación y la dependencia de la minería de roca fosfórica.31
6.4. Usos Militares
La extrema reactividad del fósforo blanco lo ha hecho útil en aplicaciones militares.4 Se utiliza en municiones para:
- Generar humo: Al arder, produce una densa nube blanca de P4O10 que actúa como pantalla visual efectiva.
- Iluminación: En bengalas y proyectiles de iluminación para campos de batalla.
- Arma incendiaria: Debido a que se inflama espontáneamente al contacto con el aire, arde a alta temperatura y es difícil de extinguir (se adhiere a las superficies y puede reencenderse), causa quemaduras térmicas y químicas muy severas.37 Su uso como arma incendiaria contra personal es controvertido y está regulado por el derecho internacional humanitario.
7. Rol Biológico del Fósforo
El fósforo, principalmente en forma de ion fosfato (PO43−) y sus derivados protonados (HPO42−, H2PO4−) o esterificados, es absolutamente esencial para toda forma de vida conocida. Desempeña múltiples roles estructurales y funcionales críticos.
7.1. Componente Estructural Esencial
- Ácidos Nucleicos (ADN y ARN): El esqueleto de las moléculas de ADN y ARN está formado por una cadena alternante de grupos fosfato y azúcares (desoxirribosa en ADN, ribosa en ARN). Los grupos fosfato unen los azúcares consecutivos mediante enlaces fosfodiéster, proporcionando la estructura polimérica y la carga negativa a estas macromoléculas portadoras de la información genética.4
- Membranas Celulares: Los fosfolípidos son los componentes principales de todas las membranas biológicas (membrana plasmática y membranas de orgánulos). Estas moléculas anfipáticas tienen una «cabeza» hidrofílica que contiene un grupo fosfato y una «cola» hidrofóbica de ácidos grasos. En un medio acuoso, se autoensamblan formando una bicapa lipídica que actúa como barrera selectiva, definiendo los compartimentos celulares.11
- Huesos y Dientes: El fósforo, junto con el calcio, es el principal componente mineral del tejido óseo y dental en los vertebrados. Se encuentra mayoritariamente en forma de cristales de hidroxiapatita (Ca10(OH)2(PO4)6), que confieren dureza, rigidez y resistencia mecánica a estos tejidos.4 Aproximadamente el 85% del fósforo total del cuerpo humano se localiza en huesos y dientes, siendo el segundo mineral más abundante después del calcio.10
7.2. Papel Metabólico y Funcional
- Transferencia de Energía: El fósforo es central en el metabolismo energético celular a través del adenosín trifosfato (ATP). El ATP actúa como la «moneda energética» universal de la célula, almacenando la energía liberada en procesos catabólicos (como la respiración celular) en los enlaces fosfoanhídrido de alta energía entre sus grupos fosfato. La hidrólisis de estos enlaces (ATP → ADP + Pi o ATP → AMP + PPi) libera energía que impulsa la gran mayoría de los procesos celulares que requieren energía (biosíntesis, transporte activo, contracción muscular, etc.).4
- Regulación Celular por Fosforilación: La adición reversible de grupos fosfato a moléculas, especialmente a proteínas, es un mecanismo fundamental de regulación celular. Las enzimas quinasas catalizan la fosforilación (transferencia de un grupo fosfato desde el ATP a un sustrato), mientras que las fosfatasas catalizan la desfosforilación (eliminación del grupo fosfato). La fosforilación/desfosforilación de proteínas en residuos específicos de aminoácidos (serina, treonina, tirosina) actúa como un interruptor molecular, alterando la conformación, actividad, localización o interacciones de la proteína. Este mecanismo controla una miríada de procesos celulares, incluyendo vías de señalización, ciclo celular, metabolismo, transcripción génica y apoptosis.9 Esta capacidad de actuar como un interruptor molecular ubicuo y reversible es una de las funciones más críticas del fósforo en la biología celular. La simple adición o eliminación de un grupo fosfato cargado puede encender o apagar cascadas de señalización enteras, permitiendo a las células responder dinámicamente a su entorno.
- Equilibrio Ácido-Base: Los iones fosfato (H2PO4−/HPO42−) constituyen uno de los principales sistemas tampón (buffer) intracelulares y en la orina, ayudando a mantener el pH fisiológico estable frente a la adición de ácidos o bases.22
- Transporte de Oxígeno: El compuesto 2,3-difosfoglicerato (2,3-DPG), presente en altas concentraciones en los glóbulos rojos, se une a la hemoglobina y reduce su afinidad por el oxígeno. Esto facilita la liberación de oxígeno desde la hemoglobina a los tejidos.27
- Otras Funciones: El fósforo participa en el metabolismo de carbohidratos y lípidos 13, es necesario para el crecimiento, mantenimiento y reparación de todos los tejidos y células 4, interviene en la función normal de los riñones, la contracción muscular y la transmisión de impulsos nerviosos 4, y colabora con varias vitaminas del complejo B en funciones metabólicas.13
8. Ciclo Biogeoquímico y Aspectos Ambientales
El movimiento del fósforo a través de los distintos compartimentos de la Tierra (litosfera, hidrosfera, biosfera) constituye el ciclo biogeoquímico del fósforo. Este ciclo es fundamental para mantener la disponibilidad de este nutriente esencial, pero también es susceptible a alteraciones significativas por la actividad humana, con importantes consecuencias ambientales.
8.1. Descripción del Ciclo del Fósforo
- Naturaleza del Ciclo: Es un ciclo predominantemente sedimentario.20 A diferencia de los ciclos del carbono, nitrógeno u oxígeno, el fósforo no forma compuestos gaseosos estables en condiciones ambientales. Por lo tanto, no hay un componente atmosférico significativo en su ciclo, y su movimiento global depende principalmente del transporte a través del agua, el suelo y los organismos vivos.4
- Ritmo del Ciclo: Es un ciclo biogeoquímico muy lento, especialmente en sus componentes geológicos.4 La liberación de fósforo desde las rocas y su eventual retorno a través de la sedimentación y el levantamiento geológico ocurren en escalas de tiempo de miles a millones de años.30 La parte biológica del ciclo (absorción por organismos, transferencia trófica, descomposición) es mucho más rápida, pero la tasa global está limitada por la lenta renovación del fósforo disponible.
- Reservorios Principales: La mayor reserva de fósforo en la Tierra se encuentra en la litosfera, en forma de minerales de fosfato (principalmente apatita) en rocas ígneas, metamórficas y sedimentarias. Los sedimentos oceánicos profundos constituyen otro reservorio importante a largo plazo.4 Los organismos vivos (biosfera) y el suelo contienen cantidades mucho menores, pero biológicamente muy activas.
- Etapas Clave del Ciclo:
- Meteorización: Las rocas que contienen fosfatos en la superficie terrestre son lentamente descompuestas por procesos físicos (congelación-descongelación, abrasión) y químicos (disolución por lluvia ácida o ácidos orgánicos producidos por organismos). Este proceso libera iones fosfato inorgánico (PO43−, HPO42−, H2PO4−) solubles al suelo y a las aguas superficiales y subterráneas.4
- Absorción por Productores: Las plantas terrestres absorben activamente los fosfatos disueltos del suelo a través de sus raíces. En los ecosistemas acuáticos, el fitoplancton, las algas y las plantas acuáticas absorben los fosfatos disueltos en el agua.4 Una vez absorbido, el fósforo se incorpora a las biomoléculas orgánicas esenciales (ADN, ARN, ATP, fosfolípidos, etc.).
- Transferencia en la Cadena Trófica: Los animales herbívoros obtienen fósforo al consumir plantas. Los carnívoros lo obtienen al consumir herbívoros u otros carnívoros. De esta manera, el fósforo se transfiere a través de los diferentes niveles tróficos del ecosistema.4
- Descomposición y Mineralización: Cuando las plantas y animales mueren, sus restos orgánicos son descompuestos por microorganismos (bacterias y hongos) en el suelo y en el agua. Durante este proceso, el fósforo orgánico contenido en las biomoléculas es liberado nuevamente al medio en forma de fosfato inorgánico soluble (mineralización), quedando disponible para ser absorbido de nuevo por los productores.4 La excreción de desechos por los animales (orina, heces) también devuelve fósforo al ambiente.22
- Sedimentación: Una parte del fosfato inorgánico disuelto en ríos, lagos y océanos puede precipitar (especialmente en combinación con calcio) o ser adsorbido por partículas minerales y sedimentar en el fondo. En los océanos, los restos de organismos marinos (huesos, conchas) también contribuyen a la acumulación de fósforo en los sedimentos. Con el tiempo geológico, estos sedimentos pueden compactarse y litificarse, formando nuevas rocas fosfatadas.4 Este proceso retira eficazmente el fósforo de la circulación biológica activa durante largos períodos.
- Levantamiento Geológico: Las rocas fosfatadas formadas en el fondo marino pueden ser elevadas y expuestas en la superficie terrestre a través de procesos tectónicos muy lentos (como la orogénesis), donde la meteorización puede comenzar de nuevo, cerrando así el ciclo geológico a muy largo plazo.29 La actividad volcánica también puede liberar algo de fósforo.29
8.2. Impacto Humano en el Ciclo del Fósforo
Las actividades humanas han alterado drásticamente el ciclo natural del fósforo, principalmente acelerando la transferencia de fósforo desde los reservorios geológicos (rocas) y terrestres hacia los ecosistemas acuáticos.
- Minería y Fertilizantes: La extracción masiva de roca fosfórica para producir fertilizantes sintéticos es la mayor perturbación humana del ciclo.20 La aplicación de estos fertilizantes en la agricultura introduce enormes cantidades de fósforo en los suelos, a menudo superando la capacidad de absorción de los cultivos. El excedente se pierde fácilmente por erosión y escorrentía hacia ríos y lagos.4
- Ganadería Intensiva: La cría concentrada de animales genera grandes cantidades de estiércol rico en fósforo. Si este estiércol no se maneja adecuadamente, el fósforo puede filtrarse o ser arrastrado a las aguas superficiales y subterráneas.53
- Aguas Residuales: Las aguas residuales urbanas contienen fósforo procedente de los excrementos humanos y, históricamente, de los detergentes con fosfatos. Aunque el tratamiento de aguas residuales elimina parte del fósforo, los vertidos de las depuradoras (especialmente si no tienen tratamiento terciario) siguen siendo una fuente importante de fósforo para los ecosistemas acuáticos.4 Los vertidos industriales también pueden contribuir.
- Deforestación y Uso del Suelo: La eliminación de la cubierta vegetal natural (bosques, pastizales) para la agricultura, la urbanización o la tala aumenta la erosión del suelo, lo que incrementa el transporte de fósforo (unido a las partículas del suelo) hacia los cuerpos de agua.67
Esta masiva movilización antropogénica de fósforo desde reservorios geológicos y terrestres relativamente inertes hacia la hidrosfera biológicamente activa representa un desacoplamiento fundamental con el lento ciclo natural. Mientras que la liberación natural de fósforo por meteorización es un proceso geológico lento, las actividades humanas han acelerado esta liberación en órdenes de magnitud, provocando impactos ambientales rápidos y severos en escalas de tiempo humanas.20
8.3. Eutrofización: La Consecuencia del Exceso de Fósforo
La consecuencia ambiental más grave de la alteración del ciclo del fósforo es la eutrofización de los cuerpos de agua.
- Definición y Causas: La eutrofización es el proceso de enriquecimiento excesivo de un ecosistema acuático con nutrientes químicos, principalmente fósforo (en sistemas de agua dulce) y nitrógeno (a menudo limitante en sistemas marinos).19 Las principales fuentes antropogénicas de estos nutrientes son la escorrentía agrícola cargada de fertilizantes, los vertidos de aguas residuales (urbanas, industriales, ganaderas) y, en el pasado, los detergentes fosfatados.4
- Proceso y Consecuencias: El exceso de nutrientes actúa como un fertilizante para las algas y el fitoplancton en el agua, desencadenando una serie de efectos perjudiciales:
- Proliferación de Algas (Blooms): Se produce un crecimiento masivo y rápido de algas planctónicas y/o cianobacterias, formando densas capas en la superficie del agua (conocidas como «blooms» o floraciones algales).19
- Reducción de la Luz y Muerte de Plantas Sumergidas: La densa capa de algas impide la penetración de la luz solar a las capas inferiores del agua. Esto provoca la muerte de las plantas acuáticas sumergidas (macrófitos) que necesitan luz para la fotosíntesis.72
- Agotamiento del Oxígeno (Hipoxia/Anoxia): Cuando la enorme biomasa de algas muere, su descomposición por parte de bacterias aeróbicas consume grandes cantidades del oxígeno disuelto en el agua, especialmente en las capas profundas.19 Esto lleva a condiciones de bajo oxígeno (hipoxia) o ausencia total de oxígeno (anoxia).
- Mortalidad de la Fauna Acuática («Zonas Muertas»): La falta de oxígeno provoca la muerte masiva de peces, crustáceos, moluscos y otros organismos acuáticos que dependen del oxígeno disuelto para respirar, creando las llamadas «zonas muertas».19
- Pérdida de Biodiversidad: La eutrofización simplifica drásticamente la estructura del ecosistema acuático, favoreciendo a unas pocas especies tolerantes (algas, bacterias) y eliminando muchas otras, lo que resulta en una pérdida significativa de biodiversidad.53
- Producción de Toxinas: Algunas especies de algas y cianobacterias que proliferan durante la eutrofización pueden producir toxinas (cianotoxinas) que son perjudiciales o letales para la vida acuática, los animales domésticos y salvajes que beben el agua, e incluso para los humanos (problemas gastrointestinales, hepáticos, neurológicos, irritaciones de piel).19 Esto puede comprometer la seguridad del agua potable.
- Deterioro de la Calidad del Agua y Usos: El agua eutrofizada a menudo presenta mal olor y sabor, turbidez y coloración verdosa o marrón, lo que la hace inadecuada para el consumo, el uso recreativo (natación, pesca) y afecta negativamente al turismo y la pesca comercial.19
- Soluciones: Abordar la eutrofización requiere reducir la carga de nutrientes que llegan a los ecosistemas acuáticos. Las estrategias incluyen:
- Control en Origen: Mejorar las prácticas agrícolas para aumentar la eficiencia en el uso de fertilizantes (agricultura de precisión, dosis adecuadas, aplicación localizada, cultivos de cobertura), manejo adecuado del estiércol, tratamiento avanzado de aguas residuales (eliminación de N y P), restauración y protección de riberas y humedales (que actúan como filtros naturales), y la prohibición o limitación de fosfatos en detergentes.19
- Remediación in situ: Técnicas como la aireación artificial para aumentar el oxígeno disuelto, la eliminación física de algas, la adición de productos químicos para precipitar el fósforo (ej. sales de aluminio o hierro), o el uso de tecnologías como ultrasonidos para controlar las algas.75
- Recuperación y Reciclaje: Tecnologías como la precipitación de estruvita para recuperar el fósforo de las aguas residuales y convertirlo en fertilizante.31
El fósforo ejemplifica una paradoja ambiental moderna: es un recurso no renovable, geográficamente concentrado y absolutamente esencial para la producción de alimentos 9, pero su manejo ineficiente lo convierte en un contaminante ubicuo y dañino para los ecosistemas acuáticos.19 La gestión sostenible del fósforo debe, por tanto, abordar simultáneamente la conservación del recurso (asegurando el suministro a largo plazo) y la prevención de la contaminación (minimizando las pérdidas al medio ambiente). Esto requiere un enfoque integrado que incluya la mejora de la eficiencia en toda la cadena alimentaria, desde la mina hasta el campo y la mesa, y el desarrollo e implementación de tecnologías de recuperación y reciclaje para cerrar el ciclo de nutrientes, avanzando hacia una economía circular del fósforo.
9. Conclusión
El fósforo (P), elemento número 15 de la tabla periódica, es una sustancia de extraordinaria importancia y complejidad. Su descubrimiento marcó un hito en la historia de la química, y su nombre, «portador de luz», alude a la intrigante quimioluminiscencia de su alótropo blanco. Este elemento nunca se encuentra libre en la naturaleza debido a su alta reactividad, existiendo principalmente en forma de minerales de fosfato.
Una de las características más notables del fósforo es su alotropía, manifestándose en formas tan diversas como el fósforo blanco (P4), altamente reactivo, volátil y tóxico; el fósforo rojo, polimérico, más estable y menos peligroso; y el fósforo negro, la forma más estable, semiconductora y estructuralmente similar al grafito. Estas diferencias estructurales dictan propiedades físicas y químicas radicalmente distintas, lo que a su vez determina sus variadas aplicaciones, desde cerillas y fertilizantes hasta semiconductores y, lamentablemente, armas incendiarias.
Químicamente, el fósforo es versátil, exhibiendo múltiples estados de oxidación (principalmente -3, +3, +5) y formando una plétora de compuestos vitales. Los óxidos (P4O6, P4O10), los oxoácidos (destacando el ácido fosfórico, H3PO4, y el fosforoso, H3PO3) y, sobre todo, los fosfatos (PO43− y sus derivados) son centrales tanto en la industria como en la biología. El ácido fosfórico es la piedra angular de la industria de fertilizantes, mientras que los fosfatos son la moneda corriente del fósforo en los sistemas vivos.
Biológicamente, el fósforo es insustituible. Como componente estructural del ADN, ARN y las membranas celulares, y como actor clave en la transferencia de energía (ATP) y la regulación celular (fosforilación), es fundamental para la propia definición de la vida.
El ciclo biogeoquímico del fósforo, predominantemente sedimentario y naturalmente muy lento, ha sido profundamente alterado por las actividades humanas. La extracción masiva de roca fosfórica para fertilizantes y el vertido de aguas residuales han movilizado enormes cantidades de fósforo hacia los ecosistemas acuáticos, causando eutrofización generalizada. Este fenómeno, caracterizado por la proliferación de algas, el agotamiento del oxígeno y la creación de «zonas muertas», representa una grave amenaza para la biodiversidad acuática y la calidad del agua.
En resumen, el fósforo se presenta como un elemento de dualidades: esencial para la vida y la agricultura, pero también un contaminante cuando se maneja de forma inadecuada; un recurso finito cuya gestión sostenible es crucial para el futuro, pero cuyas pérdidas actuales son masivas. Abordar los desafíos asociados al fósforo requiere un enfoque holístico que integre la mejora de la eficiencia en su uso, la prevención de la contaminación y el desarrollo de tecnologías de recuperación y reciclaje, como la producción de estruvita, para avanzar hacia una economía verdaderamente circular de este elemento vital. La comprensión profunda de su química, biología y ciclo ambiental es indispensable para navegar esta compleja relación entre la necesidad humana y la sostenibilidad planetaria.
Obras citadas
Ciclo del fósforo: qué es, características, etapas, importancia – Pinterest, fecha de acceso: abril 22, 2025, https://www.pinterest.com/pin/60657926218364501/
prtr-es.es, fecha de acceso: abril 22, 2025, https://prtr-es.es/Fosforo-total,15600,11,2007.html#:~:text=El%20f%C3%B3sforo%20es%20un%20elemento,at%C3%B3mico%2015%20y%20s%C3%ADmbolo%20P.
Fósforo total | PRTR España, fecha de acceso: abril 22, 2025, https://prtr-es.es/Fosforo-total,15600,11,2007.html
Descubrimiento del fósforo – Clickmica, fecha de acceso: abril 22, 2025, https://clickmica.fundaciondescubre.es/conoce/elementos-quimicos/descubrimiento-del-fosforo/
Fósforo – Qué es, propiedades y para qué sirve – Concepto, fecha de acceso: abril 22, 2025, https://concepto.de/fosforo/
Fosforo symbol – Phosphorus in Spanish language – Element number 15… – Pinterest, fecha de acceso: abril 22, 2025, https://ca.pinterest.com/pin/804103708452207908/
TABLA PERIÓDICA DE LOS ELEMENTOS – CSN, fecha de acceso: abril 22, 2025, https://www.csn.es/documents/10182/914801/FDE-01.08+Tabla+peri%C3%B3dica+%28P%C3%B3ster%29
FÓSFORO. TABLA PERIÓDICA DE LOS ELEMENTOS QUÍMICOS. – YouTube, fecha de acceso: abril 22, 2025, https://www.youtube.com/watch?v=weBy2EvEeNE
P fósforo | Otros no metálicos – Minerales, cristales, fósiles y meteoritos coleccionables., fecha de acceso: abril 22, 2025, https://mineraly.es/mineralogia/elementos-quimicos/phosphore-p
Fósforo – quimica.es, fecha de acceso: abril 22, 2025, https://www.quimica.es/enciclopedia/F%C3%B3sforo_%28elemento%29.html
Fósforo, fecha de acceso: abril 22, 2025, http://medbox.iiab.me/kiwix/wikipedia_es_medicine_maxi_2020-01/A/F%C3%B3sforo
Fósforo – Wikipedia, la enciclopedia libre, fecha de acceso: abril 22, 2025, https://es.wikipedia.org/wiki/F%C3%B3sforo
Fósforo – Tabla Periódica, fecha de acceso: abril 22, 2025, https://es.periodic-table.io/element-15
Fósforo, más que un elemento, fecha de acceso: abril 22, 2025, https://www.uhu.es/revista-uhuniverso/archivos/23-24_Molecular-FME.pdf
El fósforo, un elemento esencial para la vida que también puede acabar con ella, fecha de acceso: abril 22, 2025, https://es-us.noticias.yahoo.com/f%C3%B3sforo-elemento-esencial-vida-acabar-134329893.html
Tema 8. Fósforo y sus Compuestos, fecha de acceso: abril 22, 2025, https://www.uv.es/moratal/QI_1/Tema_8_Fosforo.pdf
Formas alotrópicas | MarieCuriesNews, fecha de acceso: abril 22, 2025, https://mariecuriesnews.wordpress.com/tag/formas-alotropicas/
concepto.de, fecha de acceso: abril 22, 2025, https://concepto.de/fosforo/#:~:text=Propiedades%20qu%C3%ADmicas%20del%20f%C3%B3sforo&text=Es%20el%20m%C3%A1s%20reactivo.,se%20transforma%20en%20f%C3%B3sforo%20rojo.
8.9.1: Propiedades y reacciones generales – LibreTexts Español, fecha de acceso: abril 22, 2025, https://espanol.libretexts.org/Quimica/Qu%C3%ADmica_Inorg%C3%A1nica/Mapa%3A_Qu%C3%ADmica_Inorg%C3%A1nica_(LibreTextos)/08%3A_Qu%C3%ADmica_de_los_Elementos_del_Grupo_Principal/8.09%3A_La_familia_del_nitr%C3%B3geno/8.9.01%3A_Propiedades_y_reacciones_generales
El ciclo del fósforo (artículo) | Ecología – Khan Academy, fecha de acceso: abril 22, 2025, https://es.khanacademy.org/science/biology/ecology/biogeochemical-cycles/a/the-phosphorous-cycle
Ciclo Biogeoquímico del Fósforo – YouTube, fecha de acceso: abril 22, 2025, https://www.youtube.com/watch?v=RwpQJILfDwg&pp=0gcJCdgAo7VqN5tD
TECNOLOGÍA QUÍMICA INDUSTRIAL Ácido fosfórico y fosfatos 1 TEMA VI. LA INDUSTRIA DEL ÁCIDO FOSFÓRICO Y DE LOS FOSFATOS. 1., fecha de acceso: abril 22, 2025, https://www.diquima.upm.es/old_diquima/docencia/tqindustrial/docs/cap4_fosforico.pdf
Ciclo del Fósforo: Importancia, concepto y etapas – Wuolah, fecha de acceso: abril 22, 2025, https://wuolah.com/blog/ciclo-del-fosforo/
Diseño de una planta química para la producción de ácido fosfórico a partir de la fosforita cubana. Autora – Dspace@UCLV, fecha de acceso: abril 22, 2025, https://dspace.uclv.edu.cu/bitstreams/41159561-a629-4ec3-a4f2-670c4686776f/download
Roca Fosfórica – UPME, fecha de acceso: abril 22, 2025, https://www1.upme.gov.co/simco/Cifras-Sectoriales/Datos/mercado-inter/Producto2_Roca_fosf_FINAL_12DIC2018.pdf
Fósforo – Productos y descripción general de los parámetros de calidad del agua | Hach, fecha de acceso: abril 22, 2025, https://es.hach.com/parameters/phosphorus
obtencion de fertilizantes fosfatados (sft) a partir de roca fosforica importada y acido – inglomayor, fecha de acceso: abril 22, 2025, https://www.inglomayor.cl/2/pierre/pdf/012.pdf
Fósforo | Linus Pauling Institute | Oregon State University, fecha de acceso: abril 22, 2025, https://lpi.oregonstate.edu/es/mic/minerales/fosforo
Fósforo – Datos en español – NIH Office of Dietary Supplements, fecha de acceso: abril 22, 2025, https://ods.od.nih.gov/factsheets/Phosphorus-DatosEnEspanol/
Ciclo del fósforo – Qué es, etapas y su importancia – Concepto, fecha de acceso: abril 22, 2025, https://concepto.de/ciclo-del-fosforo/
Ciclo del fósforo: Etapas e importancia del ciclo | StudySmarter, fecha de acceso: abril 22, 2025, https://www.studysmarter.es/resumenes/biologia/microbiologia/ciclo-del-fosforo/
STRUVIA™ – Veolia Water Technologies, fecha de acceso: abril 22, 2025, https://www.veoliawatertechnologies.es/sites/g/files/dvc2991/files/document/2020/11/49348-160266_Brochure_STRUVIA_SP_v4.pdf
Alótropos del fósforo – Wikipedia, la enciclopedia libre, fecha de acceso: abril 22, 2025, https://es.wikipedia.org/wiki/Al%C3%B3tropos_del_f%C3%B3sforo
Alotropía en el fósforo | Textos Científicos, fecha de acceso: abril 22, 2025, https://www.textoscientificos.com/quimica/fosforo/alotropia
concepto.de, fecha de acceso: abril 22, 2025, https://concepto.de/fosforo/#:~:text=Al%C3%B3tropos%20del%20f%C3%B3sforo,-Este%20elemento%20qu%C3%ADmico&text=El%20f%C3%B3sforo%20blanco%20es%20muy,inflamable%20y%20conduce%20la%20electricidad.
Lo que no sabías del fósforo: qué es el fósforo y curiosidades – ZS España, fecha de acceso: abril 22, 2025, https://www.zschimmer-schwarz.es/noticias/que-es-el-fosforo-curiosidades/
Fosforo | PDF | Fósforo | Química Física – Scribd, fecha de acceso: abril 22, 2025, https://ru.scribd.com/document/465010852/Fosforo
Fósforo blanco, fecha de acceso: abril 22, 2025, https://www.who.int/es/news-room/fact-sheets/detail/white-phosphorus
18.8 Incidencia, preparación y propiedades del fósforo – Química 2ed | OpenStax, fecha de acceso: abril 22, 2025, https://openstax.org/books/qu%C3%ADmica-2ed/pages/18-8-incidencia-preparacion-y-propiedades-del-fosforo
18.8: La ocurrencia, preparación y propiedades del fósforo – LibreTexts Español, fecha de acceso: abril 22, 2025, https://espanol.libretexts.org/Quimica/Libro%3A_Qu%C3%ADmica_General_(OpenSTAX)/18%3A_Los_metales_metaloides_y_no_metales_representativos/18.08%3A_Occurrence_Preparation_and_Properties_of_Phosphorus
Fósforo, incompatibilidades químicas y condiciones a evitar, fecha de acceso: abril 22, 2025, https://smantenimiento.us.es/uma/incompatibilidades.php?q=F%C3%B3sforo
Cap. 18Resumen – Química 2ed | OpenStax, fecha de acceso: abril 22, 2025, https://openstax.org/books/qu%C3%ADmica-2ed/pages/18-resumen
Quema de Fósforo Blanco en Oxígeno: Naturaleza Exotérmica y Riesgos Asociados | TikTok, fecha de acceso: abril 22, 2025, https://www.tiktok.com/@quimicafacil/video/7343014568232226053
Compuestos del fósforo con halógenos | Textos Científicos, fecha de acceso: abril 22, 2025, https://www.textoscientificos.com/quimica/fosforo/compuestos-halogenos
8.5: Halouros de Fósforo – LibreTexts Español, fecha de acceso: abril 22, 2025, https://espanol.libretexts.org/Quimica/Qu%C3%ADmica_Inorg%C3%A1nica/Qu%C3%ADmica_de_los_Elementos_del_Grupo_Principal_(Barron)/08%3A_Grupo_15_-_Los_pnict%C3%B3genos/8.05%3A_Halouros_de_F%C3%B3sforo
SEMANA 7 – COMPUESTOS DEL FOSFORO (1).pptx – SlideShare, fecha de acceso: abril 22, 2025, https://es.slideshare.net/slideshow/semana-7-compuestos-del-fosforo-1-pptx/270518633
NTP 237: Reacciones químicas peligrosas con el agua – PDF – INSST, fecha de acceso: abril 22, 2025, https://www.insst.es/documentacion/colecciones-tecnicas/ntp-notas-tecnicas-de-prevencion/7-serie-ntp-numeros-226-a-260-ano-1990/ntp-237-reacciones-quimicas-peligrosas-con-el-agua
Ácido fosforoso – Wikipedia, la enciclopedia libre, fecha de acceso: abril 22, 2025, https://es.wikipedia.org/wiki/%C3%81cido_fosforoso
La reacción del fósforo blanco con NaOH acuoso da | Chegg.com, fecha de acceso: abril 22, 2025, https://www.chegg.com/homework-help/questions-and-answers/la-reacci-n-del-f-sforo-blanco-con-naoh-acuoso-da-fosfina-junto-con-otro-compuesto-que-con-q112350753
Fosforo Grupo V | PDF | Ácido | Calcio – Scribd, fecha de acceso: abril 22, 2025, https://es.scribd.com/presentation/413113056/fosforo-grupo-v
Ácido hipofosforoso – Wikipedia, la enciclopedia libre, fecha de acceso: abril 22, 2025, https://es.wikipedia.org/wiki/%C3%81cido_hipofosforoso
La fosfina, fosfuro de hidrógeno – cbrn.es, fecha de acceso: abril 22, 2025, https://cbrn.es/?p=975
Archivo por meses: junio 2017 – cbrn.es, fecha de acceso: abril 22, 2025, https://cbrn.es/?m=201706
¿Qué es el fósforo y por qué aumenta la preocupación por su impacto ambiental? – UNEP, fecha de acceso: abril 22, 2025, https://www.unep.org/es/noticias-y-reportajes/reportajes/que-es-el-fosforo-y-por-que-aumenta-la-preocupacion-por-su-impacto
universidad autónoma del estado de mexico, fecha de acceso: abril 22, 2025, https://www.iaea.org/inis/collection/NCLCollectionStore/_Public/27/021/27021297.pdf
instituto politecnico nacional – Tesis IPN, fecha de acceso: abril 22, 2025, https://tesis.ipn.mx/jspui/bitstream/123456789/17037/1/25-1-16630.pdf
Producción de Ácido Fosfórico Por El Proceso de Horno de Arco Eléctrico A Partir de Roca Fosfórica | PDF – Scribd, fecha de acceso: abril 22, 2025, https://es.scribd.com/document/208790930/Produccion-de-Acido-Fosforico-por-el-proceso-de-Horno-de-Arco-Electrico-a-partir-de-Roca-Fosforica
Tecnología para Obtener Acido Fosfórico | PDF | Hogar y jardín – Scribd, fecha de acceso: abril 22, 2025, https://fr.scribd.com/document/91019825/TECNOLOGIA-PARA-OBTENER-ACIDO-FOSFORICO
Guías sobre medio ambiente, salud y seguridad para la fabricación de fertilizantes de fosfato, fecha de acceso: abril 22, 2025, https://www.ifc.org/content/dam/ifc/doc/2000/2007-phosphate-fertilizer-ehs-guidelines-es.pdf
Diferentes tipos de fosfatos – Blog – Orenda Technologies, fecha de acceso: abril 22, 2025, https://blog.orendatech.com/es/diferentes-fostatos
Ciclo del fósforo – Wikipedia, la enciclopedia libre, fecha de acceso: abril 22, 2025, https://es.wikipedia.org/wiki/Ciclo_del_f%C3%B3sforo
Ciclos biogeoquímicos – Qué son, tipos y su importancia – Concepto, fecha de acceso: abril 22, 2025, https://concepto.de/ciclos-biogeoquimicos/
Ciclo del Fósforo: Que es, Importancia, Características y Etapas – Ciclos Biogeoquímicos, fecha de acceso: abril 22, 2025, https://ciclosbiogeoquimicos.com/ciclo-del-fosforo/
Recuperación de fósforo a partir de lodos mediante precipitación de estruvita, fecha de acceso: abril 22, 2025, https://www.aguasresiduales.info/revista/blog/recuperacion-de-fosforo-a-partir-de-lodos-mediante-precipitacion-de-estruvita
Eliminación y recuperación de fósforo (P) – Portal Agrari, fecha de acceso: abril 22, 2025, https://portalagrari.gva.es/documents/366567370/373114908/Eliminaci%C3%B3n+y+recuperaci%C3%B3n+de+f%C3%B3sforo+%28P%29.pdf/aa2c2cdd-f1d0-4ad3-9e44-9b3d5520753b?t=1687851313755
RECUPERACIÓN DE FÓSFORO MEDIANTE PRECIPITACIÓN DE ESTRUVITA CON FUENTES ALTERNATIVAS DE MAGNESIO, fecha de acceso: abril 22, 2025, https://www.aeas.es/images/doc_congreso/castellon2022/GT%20I+D+i%2003%20RECUPERACION%20DE%20FOSFORO%20MEDIANTE%20PRECIPITACION%20DE%20ESTRUVITA%20CON%20FUENTES%20ALTERNATIVAS%20DE%20MAGNESIO%20-%20NILSA%20-%20ANDREA%20LOPEZ.pdf
Desarrollan tecnología capaz de generar fertilizantes naturales desde las aguas residuales, fecha de acceso: abril 22, 2025, https://www.diariousach.cl/desarrollan-tecnologia-capaz-de-generar-fertilizantes-naturales-desde-las
¿Qué es la eutrofización y cómo contamina el agua? – Fundación Aquae, fecha de acceso: abril 22, 2025, https://www.fundacionaquae.org/wiki/eutrofizacion/
Causas de la eutrofización, fecha de acceso: abril 22, 2025, https://www.miteco.gob.es/es/agua/temas/estado-y-calidad-de-las-aguas/proteccion-eutrofizacion/causas.html
Estudio de recuperación de fósforo del agua de – CORE, fecha de acceso: abril 22, 2025, https://core.ac.uk/download/pdf/290001223.pdf
Ceit impulsa la recuperación de fósforo en el proceso de depuración de aguas residuales, fecha de acceso: abril 22, 2025, https://www.ceit.es/noticias/-/contents/11/02/2025/ceit-impulsa-la-recuperacion-de-fosforo-en-el-proceso-de-depuracion-de-aguas-residuales/content/1tZ9oin6Nj8k/150259413
Paquete formativo 3 Operadores de regeneración del agua – Fact-sheet 3.5 – Recuperación de fósforo en la reutilización del agua – SUWANU Europe, fecha de acceso: abril 22, 2025, https://suwanu-europe.eu/wp-content/uploads/2021/03/IP3_FS3.5_-TTZ_SP-1.pdf
La eutrofización sofoca los ecosistemas acuáticos y estas son sus consecuencias, fecha de acceso: abril 22, 2025, https://municipiods.com/eutrofizacion/
Eutrofización: causas, consecuencias y soluciones – Oxifuch, fecha de acceso: abril 22, 2025, https://oxifuch.com/eutrofizacion/
Eutrofización: Causas, consecuencias y soluciones – iAgua, fecha de acceso: abril 22, 2025, https://www.iagua.es/noticias/sewervac-iberica/eutrofizacion-causas-consecuencias-y-soluciones
Contaminación de nutrientes y proliferación de algas: causas y soluciones – LG Sonic, fecha de acceso: abril 22, 2025, https://www.lgsonic.com/es/contaminacion-de-nutrientes-y-proliferacion-de-algas/
Eutrofización: efectos de contaminación de agua y tratamientos, fecha de acceso: abril 22, 2025, https://www.smasa.net/eutrofizacion/
El impacto ambiental de los detergentes que usamos – Opcions, fecha de acceso: abril 22, 2025, https://opcions.org/es/impacto-ambiental-de-los-detergentes/
Eutrofización. Huella de fosfatos., fecha de acceso: abril 22, 2025, https://www.huelladenitrato.com/eutrofizacion-huella-de-fosfatos/
ES2650250T3 – Mezclas de fosfito de aluminio con sales de aluminio poco solubles e iones ajenos exentos de nitrógeno, procedimiento para su producción, así como su uso – Google Patents, fecha de acceso: abril 22, 2025, https://patents.google.com/patent/ES2650250T3/es
Tipos De Fertilizantes Para Plantas: Usos Y Beneficios Agrícolas – EOS Data Analytics, fecha de acceso: abril 22, 2025, https://eos.com/es/blog/tipos-de-fertilizantes/
Fertilizantes Fosfatados: Tipos E Impacto En Las Plantas – EOS Data Analytics, fecha de acceso: abril 22, 2025, https://eos.com/es/blog/fertilizantes-fosfatados/
Super Phos – Huma, Inc., fecha de acceso: abril 22, 2025, https://huma.us/es/planta-y-suelo/products/macros-es/super-phos/
Fertilizantes Tecnológicos para Agricultura Sostenible – La Sembradora de Ideas, fecha de acceso: abril 22, 2025, https://lasembradoradeideas.com/fertilizantes-tecnologicos/
STRUVIA™ | Veolia Water Technologies, fecha de acceso: abril 22, 2025, https://www.latam.veoliawatertechnologies.com/es/soluciones/tecnologias/struvia
Soluciones para la recuperación de fósforo: Convertir desafíos en oportunidades medioambientales | iAgua, fecha de acceso: abril 22, 2025, https://www.iagua.es/noticias/xylem-water-solutions-espana/soluciones-recuperacion-fosforo-convertir-desafios
Eliminación biológica de fósforo en aguas residuales | Paques Biotechnology, fecha de acceso: abril 22, 2025, https://www.paquesglobal.com/es-es/aplicaciones/eliminacion-de-fosforo-en-aguas-residuales
¿Causa la eutrofización la proliferación de algas? – Huma, Inc., fecha de acceso: abril 22, 2025, https://huma.us/es/medio-ambiente/causa-la-eutrofizacion-la-proliferacion-de-algas/
WO2015128528A1 – Procedimiento y sistema de cristalización de estruvita para la recuperación de fosfatos en aguas residuales – Google Patents, fecha de acceso: abril 22, 2025, https://patents.google.com/patent/WO2015128528A1/es